脊柱手术指南:第30章-后路颈椎钉棒固定
脊柱手术指南:第26章-椎管成形术(Laminoplasty)
脊柱手术指南:第21章-颈椎前路椎间盘切除,植骨融合钢板内固定术
脊柱手术指南:第19章-颈椎前路椎间盘切除融合术(Anterior Cervical Discectomy and Fusion,ACDF)
脊柱手术指南:第22章-颈椎椎间融合器植入术
脊柱En bloc切除术(未完)
说明:
1. 翻译自Stefano Boriani.En bloc resection in the spine: a procedure of surgical oncology.J Spine Surg,2018,4(3):668–676.
一、前言
很明显,我们应该根据肿瘤学的原则来规划一项旨在切除肿瘤的外科手术。
En bloc切除术的目的是完整地切除肿瘤包块(完全被一层连续的健康组织所包绕)。
肿瘤周围的健康组织被称为“切缘(margin)”:从肿瘤学的角度来看,它的质量和厚度决定了手术的质量,影响了局部和全身的预后。
70年代,随着新辅助化疗方案的引入,该手术成为四肢骨肿瘤治疗的金标准。
这些新的化疗药物对肿瘤的作用(缩小体积,harder consistency)实现了仅切除肿瘤而不牺牲肢体(所谓的“保肢手术”)。
脊柱肿瘤的整体切除需要脊柱外科的技术和多学科处理:应用最新的技术来改善手术结果,降低手术难度和并发症发生率,更容易重复。但这些新工具的使用应始终排在落实肿瘤学原则之后。技术是手段,而不是目的。 > Technologies are the means, not the end
一些文献致力于功能性结果,不可否认,这是非常重要的。但与处理转移瘤不同的是,在原发性肿瘤的决策过程中,首要考虑的是肿瘤学原则,其次考虑的才是功能性结果。
外科医生的注意力应集中在局部复发率上,这是肿瘤外科手术有效性的最佳指标。
脊柱整体切除的外科技术经常被学者提出(不考虑肿瘤范围):最流行的脊柱肿瘤整体切除技术只有在肿瘤的生长不超过前外侧椎体皮质的情况下才具有肿瘤学上的有效性(oncological validity),否则钝性的人工切割就会突破肿瘤的边缘。
脊柱肿瘤整体切除技术:最初由Roy-Camille等人描述,而后由Tomita等人提出
Tomita提出了“Total En bloc Spondylectomy”这一术语,在我看来,这在肿瘤学上是不合适的。实际上,手术的目标不是整块切除整个椎体,而是切除一个有适当切缘的肿瘤。有时并不需要切除整个椎体。
Bertil Stener是将公认的胃肠道肿瘤的肿瘤学原则应用于脊柱的先驱。到目前为止,他关于整体切除手术计划的详细报告是非常有用和详尽的,可作为学习肿瘤学原则是如何指导手术计划的指南。他的工作代表了precedent pioneers的活动和严格遵守当时发展起来的肿瘤学原则之间的分水岭。
后来报道了一些文章,描述了不同的方法及其组合。其中一些手术具有特别强的肿瘤学承诺,其目标甚至是在牺牲相关解剖结构的情况下实现在边界外,完整切除肿瘤:硬脊膜、颈神经根、马尾神经和脊髓、主要血管结构和内脏器官。
在技术细节中,截骨(osteotomy)是讨论最多的一种技术。Roy-Camille和Stener在很多年前提出联合使用Gigli和osteotomes进行截骨术。
在这些论文中,强调了在最后几个步骤中,Gigli锯失去控制会导致硬膜囊意外损伤的风险。
Tomita(7)提出了一种更薄的锯和一套原创的器械-依靠助手的手-既能保护硬脊膜免受意外伤害,又能从前到后进行切除,两者共同完成椎弓根的冠状面切除,从而通过获得两个标本完成spondylectomy。
由Gasbarrini等人最初提出一种硬脊膜的可扩展性保护器,插入在硬脊膜和椎体后壁之间,固定在其中一根棒上:这是一种不依赖于外科医生手的防止意外损伤的安全可靠的保护措施。
在Shah等人最近发表的一篇文献中提出了线锯的一种有趣的使用方法。但它的应用局限于胸腰椎的部分节段:不适用于上胸椎和下腰椎。
根据不同的个人经验和manuality,使用凿子(chisels)、骨刀、超声骨刀、高速磨钻等均可以在不影响手术效果的情况下完成截骨手术,只要切缘合适,就可以达到截骨的目的。
为了达到可靠和平衡的重建目的,应获得一个完全平坦的截骨面,以便与cage和/或graft充分接触。
根据手术计划,还应考虑椎间盘切除术/diskectomy(和所有相关的工具),其比截骨术更可取。
在这种情况下,所有的椎间盘组织和软骨应从终板(endplates)上去除,以获得更好的cage位置和graft incorporation。
在我看来,我们应该遵循Bertil Stener在他的令人难忘的论文中所表达的伟大信息:不存在一种能够对所有脊柱肿瘤进行en bloc切除的单一外科技术,但手术技术应该根据肿瘤的范围、脊柱的位置、组织学和要达到的边缘进行规划。
最新的前沿是考虑新的放疗技术和化疗方案提供的可能性,以恢复边缘的侵犯(transgression),根据患者的需求,决定保留解剖结构,无论是偶然还是故意的 偶然发生或故意,。
二、治疗的肿瘤学基础
Enneking分期系统是一个有效和可重复的工具,用于了解和分期骨和软组织肿瘤的生物学行为,并从肿瘤学的角度决定合适的手术方法。
该系统以组织学诊断和临床、实验室及影像学研究为基础。它还向负责这些疾病的多学科小组提出了一套共同的术语。
为了简单起见,遵循Enneking分期系统的外科手术被定义Enneking appropriate。
良性侵袭性(Enneking 3期)肿瘤(如成骨细胞瘤和骨巨细胞肿瘤)和低度恶性肿瘤(Enneking stage IA和IB)(如脊索瘤和软骨肉瘤),建议En bloc切除。
在骨肉瘤和尤文肉瘤等高度恶性肿瘤(Enneking Ⅱ期)中,化疗和放疗起着非常重要的作用。
肿瘤切除后,病理学家必须仔细评估肿瘤切缘,分别定义为: wide具有相关屏障(如筋膜)或至少1厘米厚的健康骨质 marginal具有较薄的屏障(如骨膜) intralesional无意或故意侵犯肿瘤
切缘的侵犯会导致预后显著恶化。
尽管有较高的复发率,如果患者强烈要求保留解剖结构以保存功能,则仍需相应的辅助治疗。
En bloc切除在脊柱转移瘤的治疗中作用有限。这些患者的主要目标是保持或改善功能和生活质量,避免不必要的并发症。应优先考虑功能,不应计划牺牲任何重大的解剖结构导致相应的功能丧失。
当然,在一些特定的病例中,经多学科讨论后,可建议En bloc切除以减少或消除任何局部复发的危险。
根据作者(Stefano Boriani)的经验,脊柱转移瘤en bloc切除适用于单发转移灶(single localizations),原发部位的肿瘤完全得到控制,无内脏器官的侵犯,最好是在肿瘤无长期进展之后(best after long term disease free evolution)。
这一决定的关键是肿瘤缺乏对放化疗的敏感性:或者,可以将侵袭性较小的手术与这些治疗结合起来,在不降低局部治愈可能的情况下降低手术并发症率。
三、手术计划
Weinstein-Boriani-Biagini (WBB) 手术系统于1997年首次提出以对脊柱肿瘤的范围进行分期。
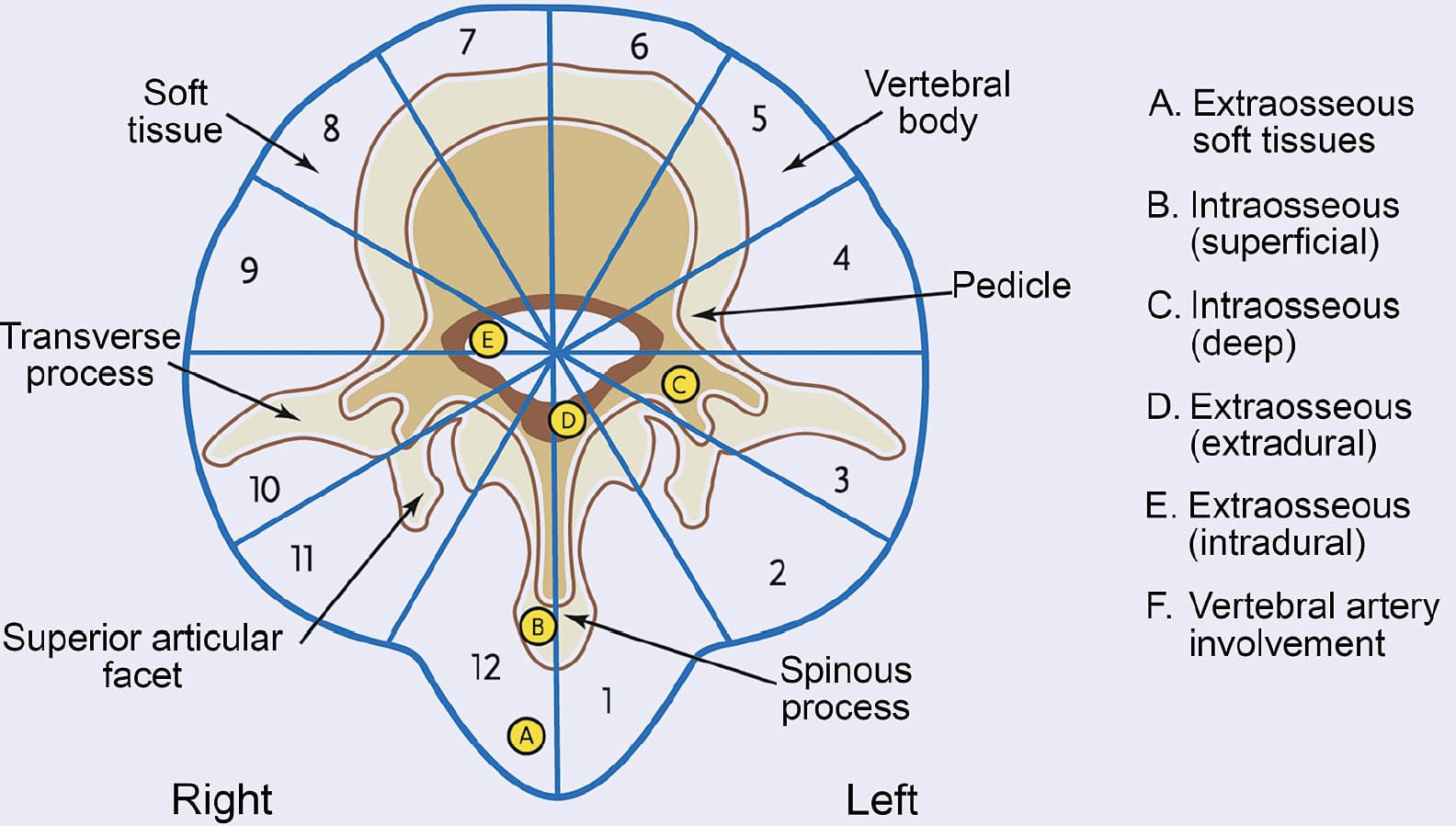
一个国际多学科的脊柱肿瘤专家小组提交了一项关于WBB系统可靠性和有效性研究,结果是在观察者间具有适当的可靠性,而在观察者内具有相当大的可靠性。
相应地,这里提出了七种手术方式,根据手术入路及其组合定义为几个亚类,共分成十种不同的手术策略。
单一前路(Single anterior approach)(type 1)
单一后路(Single posterior approach)(type 2),包括三个亚型(a,b,c)
前后联合入路(type 3),包括三个亚型(a,b,c)
(一)Type 1
单一的前路手术(Figure 1)能够对胸椎和腰椎椎体内的小体积肿瘤进行en bloc切除。
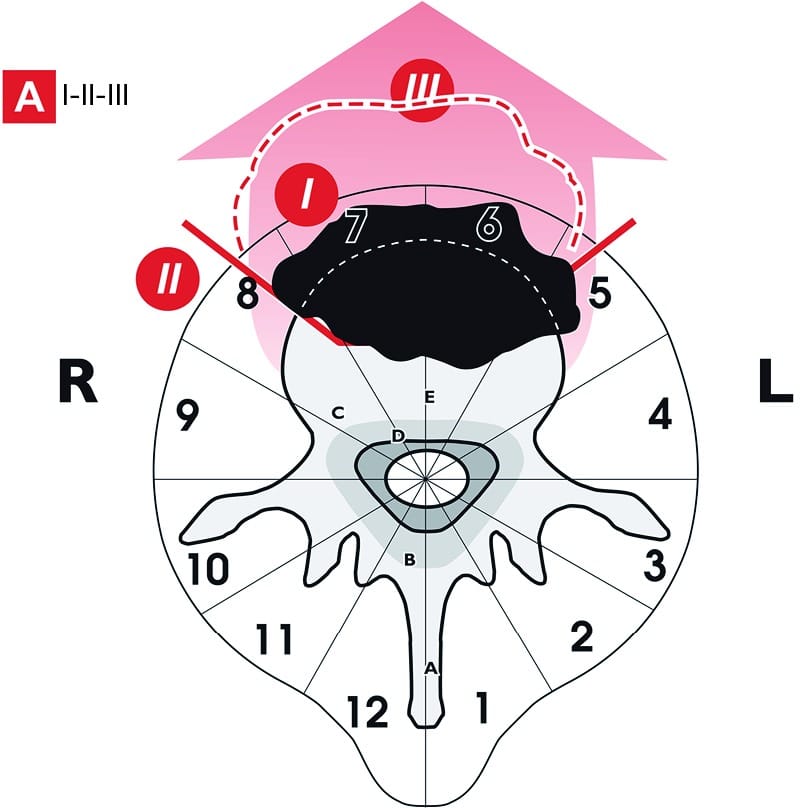
为达到无瘤切缘,肿瘤必须位于8~5区,A和B层,而不是C层。
在这种情况下,截骨实际上会侵犯肿瘤:后路是肿瘤边界外切除所必需的,其方法是通过进入椎管并释放硬脊膜,一同切除椎体的后壁。
要考虑三个步骤:第一,为在前部生长的肿瘤,提供一个在直接的视觉控制下合适的切缘(I)。第二步包括在肿瘤和后壁之间进行截骨(Ⅱ)。第三步是切除肿瘤(Ⅲ)。
the first to provide under direct visual control an appropriate margin of the anterior tumor growing (I)
(二)Type 2
单一后路能够进行许多不同的en bloc切除术,无论肿瘤是位于后结构(posterior elements),位于椎体(vertebral body)还是位于偏心部位(eccentrically located)(Figure 2)。
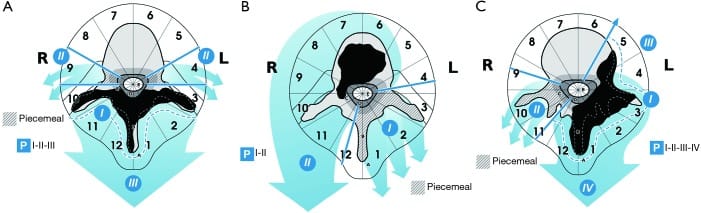
(A)单一后路,en bloc切除位于后弓(posterior arch)肿瘤。
为了获得适当的切缘,第9区和第4区必须无瘤。
如果肿瘤位于D层,则在硬脊膜释放过程中,切缘的破坏将导致瘤内切除。
这项技术包括三个步骤:第一,在后方的肿瘤包块上留下一个合适的边缘(I)。
第二步通过切除第9区和第4区进入椎管(canal)(Ⅱ)。
第三步是上、下横断椎板(transverse laminotomy above and below),将肿瘤从硬脊膜释放,en bloc切除肿瘤(Ⅲ)。
(B)单一后路。可整块切除位于椎体内的胸椎肿瘤。
为了获得无瘤切缘,第9区和第4区必须无肿瘤侵犯。
如果肿瘤位于D层,则在硬脊膜释放过程中,切缘的破坏将导致瘤内切除。
如果肿瘤延伸到A层,则在与前方结构分离的过程中可能侵犯切缘。
正如Roy-Camille和Tomita等人所描述的,这是一种最流行的en bloc脊柱肿瘤切除技术。
在进行椎板切除术(laminectomy)前,应用手指钝性分离脊柱前缘和纵隔,以减少手法分离(manual dissection)过程中损伤脊髓的风险。
如果能识别出节段血管,并在节段血管和椎体之间进行钝性剥离,则从椎体前缘释放主动脉更安全。然后切除未受累的后弓。
至少应切除4 sectors,从第4区或第9区开始(I)。
结扎并切除肿瘤所累及的神经根是必要的,硬脊膜必须完全从肿瘤中释放出来。
然后在肿瘤上方和下方进行椎间盘切除术或截骨术(Discectomy or osteotomy),然后完成肿瘤切除(Ⅱ)。
(C)单一后路,采用矢状截骨术(sagittal osteotomy)切除胸椎或腰椎中偏心生长的肿瘤。
椎体不侵犯左侧5区以上,右侧8区以上,至少3个后方区域未受累(4区到12区或1211到9区),是实现无瘤切缘en bloc切除的标准。
这项技术包括四个步骤:第一个步骤是在后方生长的肿瘤上提供一个无瘤边缘(I)。松解应沿外侧进行,直至椎体的外缘。
在胸椎,胸膜可以留在肿瘤上,在腰椎,必须解剖游离出腰大肌的后部,但必须找到并结扎节段血管。
第二步(Ⅱ)是切除不被肿瘤侵犯的后弓并进入椎管;将硬脊膜从肿瘤中释放出来(如果肿瘤位于D层,则切缘可能会造成瘤内切除),牺牲肿瘤所累及的神经根。在步骤Ⅲ中,小心地移位硬脊膜,并在8或5区从后向前进行截骨术。第四步(IV)是切除肿瘤。
(三)Type 3
一期前路,二期后路是
一种en bloc切除颈椎肿瘤的策略(Figure 3A) ,肿瘤累及椎体(不包括第6和第7区,但可以包括第4区)和后弓(至少3个区不能被侵犯)的一部分。
或位于胸椎和腰椎A层的肿瘤(Figure 3B)。
或在胸腰椎偏心性生长的肿瘤(Figure 3C,D),矢状截骨术被认为是安全的,且能够达到合适的切缘,而不需要切除整个椎体。
------未看完 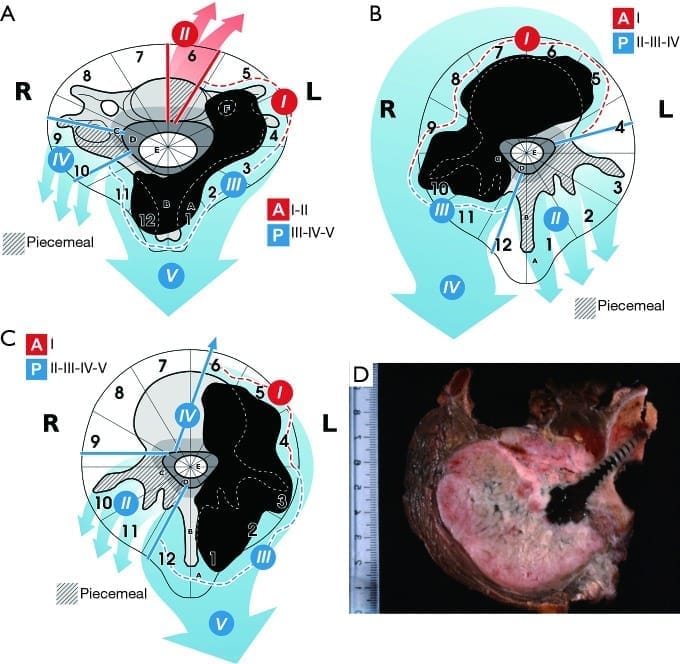
(四)Type 4
(五)Type 5
(六)Type 6
(六)Type 7
四、结论
时间协调
健侧颈7移位术治疗中枢损伤后上肢痉挛瘫的临床试验
说明:
1. 翻译自Zheng MX, Hua XY, Feng JT, et al.Trial of Contralateral Seventh Cervical Nerve Transfer for Spastic Arm Paralysis.N Engl J Med,2018,378(1):22-34.
一、背景
中风、脑外伤或脑瘫(cerebral palsy)引起的大脑半球损伤所致的痉挛性肢体瘫痪(Spastic limb paralysis)是造成长期残疾的原因之一。
据估计,30%至60%的中风幸存者无法使用他们瘫痪的手。
痉挛的手臂姿势会影响日常的生活,如个人卫生、穿衣,并可能引起疼痛。
对侧大脑半球运动区损害患者的功能损害(Functional impairment)是由于上运动神经元抑制活动中断,导致痉挛(spasticity),以及手部分段精细运动控制(fractionated fine motor control of the hand)的减弱和丧失所致。
在大脑半球损伤的恢复过程中,在同侧和对侧均观察到了神经重组(neural reorganization)。 > 对侧即瘫痪侧的大脑半球
有证据表明,对侧大脑半球参与中风后手功能的恢复,特别是在执行要求高度准确或复杂的任务时。
但是,在人类中,同侧大脑半球与瘫痪的手之间的直接联系很少,从而限制了这种代偿能力。
在我们以前研究的基础上(video),我们假设瘫痪的手可以通过将cervical spinal nerve从非瘫痪侧移位到瘫痪侧,从而在功能上连接到对侧(同侧)大脑半球。
the paralyzed hand could be functionally connected to the contralesional (ipsilateral) hemisphere by transferring a cervical spinal nerve from the nonparalyzed side to the paralyzed side.
这一方法已用于治疗臂丛神经损伤。
用这种技术激活瘫痪的手臂,既需要吻合的神经与对侧神经的生理连接,也需要移植神经损伤同侧大脑半球的连接。
通过该技术使患肢重新“激活”需要符合以下两个要求:一是将健肢的颈神经根与患肢的颈神经根通过显微缝合建立生理上的连接,二是患肢同侧的大脑半球与患肢被桥接的神经建立连接。
Activation of a paralyzed arm with this technique requires both physiological connections of the anastomosed nerve to contralateral nerves and connectivity of the cerebral hemisphere ipsilateral to the injury to the grafted nerve.
脊神经中的5个神经根(C5、C6、C7、C8和T1)组成了臂丛神经,这5个神经根共包含40,000~69,000根神经纤维,支配整个上肢。
C7神经根的纤维数在臂丛神经中约占20%。由于C7神经根的运动功能与另外4个组成臂丛神经的神经根大量交叉重叠,切断C7神经根通常只会导致同侧上肢一过性的肌力减退和感觉麻木。
在本研究中我们进行随机临床试验,对手术组患者进行健侧颈7神经移位术并检测患者临床功能变化,并通过经颅磁刺激(transcranial magnetic stimulation)和传统的神经传导检测(conventional nerve-conduction studies)来评估中枢和周围神经在神经生理学上的激活情况。
我们还通过功能神经影像(functional neuroimaging)来评估大脑激活的变化。
二、方法
(一)试验设计
我们对上海华山医院的脑损伤患者进行随机对照临床试验。
参与者的入选条件是脑卒中、脑外伤或脑瘫后的偏瘫(hemiplegia),主要表现为大脑病灶对侧上肢痉挛和肌力减退。
我们所招募患者的年龄为12~45岁,他们的瘫痪肢体经过至少5年康复已经保持稳定,不再进一步改善。
患肢的肌力和触觉(tactile sensitivity)均下降但未完全丧失(在下文关于该试验的描述中,“瘫痪(paralyzed)”一词均表示这一状态)。
使用经颅磁刺激方法刺激健侧半球(contralesional hemisphere)可诱发健肢反应,且仅在刺激损伤半球时能诱发患肢的反应。 > Transcranial magnetic stimulation had to have resulted in activation from the contralesional hemisphere to the unaffected arm and exclusive activation of the paralyzed hand by the ipsilesional hemisphere.
排除条件包括有系统性疾病(如糖尿病或心肺疾病)、发育迟缓或认知能力低下、患肢重度固定挛缩或关节畸形(severe, fixed contracture or joint deformity of the paralyzed arm)(完整的入选和排除标准见补充附录)。
本试验未包含我们前期研究中所有接受神经移位手术(nerve-grafting technique)的患者。
该试验方案获得华山医院机构审查委员会批准。向患者或患者父母提供了书面的知情同意书。
文章由第一作者和通讯作者负责撰写,所有作者为结果和分析的准确性与完整性、不良事件的报告以及试验与方案的一致性担保。
我们使用盲法以及简单、非分层的随机化方法将入选患者按照1∶1的比例分为健侧C7神经移位手术+康复组(contralateral C7 nerve–transfer surgery followed by rehabilitation)和单纯康复组(rehabilitation only)。
随机序列(randomization sequences)由独立的统计学家使用计算机生成。研究人员直到患者分组时才知道随机序列号的分配情况。
(二)试验干预方法
我们已在前期报道中描述了健侧C7神经移位术,示意图见Figure 1和interactive graphic(可在NEJM.org获取)和Supplementary Appendix中的Figure S1。
 > 图1. 健侧C7神经移位术 > 在颈根部胸骨上方2cm做一15
cm长的横切口,暴露双侧锁骨上臂丛神经。患侧C7神经在近椎间孔处切断,健侧C7神经尽量向远端游离,并在其与其他臂丛神经根合干前切断。钝性分离C7椎体前方,暴露椎体前食管,建立椎体和食管间的通路。然后将健侧C7神经的断端通过该椎前通路引至患侧,并与患侧C7断端直接进行显微镜下外膜缝合(不需移植)。术后患肢用头臂支架固定4周,然后继续进行与术前同样的康复治疗。
> 图1. 健侧C7神经移位术 > 在颈根部胸骨上方2cm做一15
cm长的横切口,暴露双侧锁骨上臂丛神经。患侧C7神经在近椎间孔处切断,健侧C7神经尽量向远端游离,并在其与其他臂丛神经根合干前切断。钝性分离C7椎体前方,暴露椎体前食管,建立椎体和食管间的通路。然后将健侧C7神经的断端通过该椎前通路引至患侧,并与患侧C7断端直接进行显微镜下外膜缝合(不需移植)。术后患肢用头臂支架固定4周,然后继续进行与术前同样的康复治疗。
为了减小手术创伤并缩短所移植的健侧神经远端(distal end of the transplanted nerve)和受体神经(recipient nerve)的距离,我们对原有手术方法进行了改良。
简单来说,我们在胸骨(sternum)上方做一切口,将健侧C7神经(donor C7 nerve)尽量向远端游离,在它与其他神经根合并之前切断,然后将健侧C7神经从椎体与食管间隙穿过至患侧。
an incision was made at the superior aspect of the sternum, and the donor C7 nerve on the nonparalyzed side was mobilized, sectioned as distally as possible but proximal to the point at which it combines with other nerves, and routed between the spinal column and esophagus
患侧的C7神经尽量向近端游离并切断,然后将健侧C7神经与患侧C7神经缝合。对照组患者未接受手术。
在12个月中,手术组与对照组患者均在同一机构接受每周4次相同的康复治疗,实施康复治疗的理疗医师对患者的分组情况非盲。
两组接受同样的康复治疗,包括主动训练、被动关节活动度训练(passive range of motion)、职业疗法(occupational therapy)、功能训练(functional training)、物理疗法、针灸(acupuncture)、推拿(massage)和穿戴矫形支具(use of orthoses)等,唯一不同是手术组在术后需要佩戴一段时间特制的制动支具(use of a special immobilizing cast)(补充附录图S2)。
(三)结局
主要结局为患者12个月末与基线相比上肢Fugl-Meyer量表总分的改变量。
Fugl-Meyer量表用于评估脑卒中后的恢复,一共包含33个检测项目,每个项目的评分标准为0~2分,其中0分代表“不能完成(cannot perform)”,1分代表“部分完成(performs partially)”,2分代表“完全完成(performs fully)”。
该量表包括了“肩肘(shoulder and elbow)”和“腕指(wrist and fingers)”两大部分。
量表总分为0~66分,评分较高代表功能较好。我们分别检测了患者基线以及纳入研究后2个月、4个月、6个月、8个月、10个月和12个月的随访结局。
次要结局包括从基线到12个月末患肢肘、前臂、腕、拇指和2~5指等5个关节的改良Ashworth量表评分的变化,以及各关节活动度的变化和患肢功能使用的变化。
其中改良Ashworth量表用于检测各关节的痉挛程度(spasticity),评分标准为0~5分,评分较高代表痉挛较严重。
上述5个关节中任一关节的痉挛评分与基线相比显著改善则认为有阳性结果。
患肢功能使用的评估包括穿衣服、系鞋带、拧毛巾和使用手机4项活动的表现。我们将能够完成3种或3种以上动作的患者占该组患者的比例作为事后分析的结果(post hoc outcome)。
其他的次要结局还包括神经生理学评估和功能磁共振成像(functional magnetic resonance imaging,fMRI)评估。
神经生理学评估(neurophysiological assessments)是通过以下方法评估:一是电刺激健侧上肢的颈神经(Erb点)并在患肢桡侧伸腕肌记录,二是分别经颅磁刺激损伤和健侧大脑半球并在患肢上肢桡侧伸腕肌记录。
fMRI检测时,我们让患者交替进行患肢的主动伸腕动作和休息,并同时扫描。
我们用视频记录了对患者进行Fugl-Meyer量表、改良Ashworth量表、关节活动度(range-of-motion testing)和患肢功能使用(functional-use assessment)等评估的过程,隐藏患者分组和治疗分配方案,并用马赛克遮住视频中患者脸部和预计手术切口的部位,由2名不知晓分组情况的康复专家对视频进行评估。
功能影像结果也由2名不知晓分组情况的研究者进行评估。
安全性结局(Safety outcomes)包括12个月中发生的不良事件以及健侧上肢在C7神经切断后肌力(muscle strength)、触觉阈值(tactile sensory threshold)和两点辨别觉(two-point discrimination)的变化。
(四)统计学分析
我们根据前期的初步研究结果,预估α水平为0.05能够检测出Fugl-Meyer评分组间差异6.6分±5.2分(均值±SD)的样本量,按照90%统计效能和20%脱落率(dropout rate)来计算,需要36例(每组18例)。
On the basis of our preliminary study, we esti- mated that a sample size of 36 (18 per group), under the assumption of a 20% dropout rate, would provide 90% power to detect a mean (±SD) difference between groups of 6.6±5.2 on the Fugl–Meyer scale at an alpha level of 0.05.
我们采用描述性统计分析患者的基线特征。针对连续变量,采用Student’s t检验(或Satterhwaite方法)或Wilcoxon秩和检验进行组间比较;采用配对t检验或Wilcoxon配对符号秩检验进行每个随访点与基线的组内比较。
对连续性结局进行基线到12个月的改变量的组间比较时,采用协方差分析(analysis of covariance)进行基线校正。
针对离散变量,采用卡方检验、Cochran-Mentel-Haenszel卡方检验或Fisher精确检验进行组间比较,采用McNemar卡方检验进行组内比较。
对改良Ashworth量表评分从基线到12个月的改变量采用卡方检验进行组间比较。P<0.05(双侧)被认为差异有统计学意义。
对fMRI结果用t contrast(fMRI功能磁共振的大脑活动中提取变化信息的统计学方法)和校正P=0.05阈值进行单个患者的分析,对所有sessions采用Boxcar分析。
对每个session的所有患者采用单样本t检验(one-sample t-test),校正P值阈值为0.05(family-wise法校正)。
fMRI变化的P值(补充附录表Tables S8,S9,S10)为患肢主动活动和休息的比较。
三、结果
(一)患者
2013年7月至2014年12月,我们对一共83例患者进行筛选;其中45例符合入选条件,最后36例患者入选。
符合条件但未入选的理由为患者拒绝非手术治疗(4例)、拒绝手术治疗(3例)或拒绝进行随机分组(2例)。
患者入选、随机分组和随访的流程示意图见Figure S3 in the Supplementary Appendix。
手术组和对照组从最初的神经损伤到进入临床试验(即基线)的时间(均值±SD)分别为15年±9年和15年±8年;手术组和对照组入组前康复时长分别为10年±4年和10年±3年;手术组和对照组最近一次康复到随机分组的时间分别为5年±7年和5年±6年。
患者大脑损伤的原因有脑卒中、脑外伤、脑瘫(先天性偏瘫)cerebral palsy (congenital hemiplegia)和脑炎(encephalitis)(Table 1),对照组有8例患者为脑瘫引起的偏瘫,而手术组仅有5例脑瘫患者,除此之外两组患者基线的人口学特征、Fugl-Meyer评分或Ashworth评分没有显著差异。
入组时所有患者都无法用患手完成伸手够取物体和抓取的动作,无法穿衣服、系鞋带、拧毛巾或使用手机。
(二)主要结局
手术组和对照组从基线到12个月的总Fugl-Meyer评分平均改变量(均值±SD)分别为17.7分±5.6分和2.6分±2.0分,手术组的结果显著优于对照组(两组差异为15.1分,95% CI,12.2~17.9,P<0.001)(Table 2)。
手术组在10个月和12个月时可见评分显著增加(Fig. S5 in the Supplementary Appendix)。
事后分析显示(post hoc analysis),对各脑损伤病因亚组分析Fugl-Meyer评分改善,其组间比较结果和所有患者的组间比较结果没有显著差异(Table S1 in the Supplemen- tary Appendix),但每个亚组的患者数较少。
(三)次要结局
改良Ashworth量表检测患肢痉挛的结果显示,手术组所有关节从基线到12个月的痉挛改善均显著优于对照组(伸肘,P<0.001;前臂旋转,P=0.003;伸腕,P=0.005;伸拇,P=0.02;伸二~五指,P=0.008)(Table 2)。
从基线到12个月患肢各关节活动度结果显示,手术组的肘、前臂和腕关节活动度分别平均增加了23°±13°、36°±19°和49°±21°,而对照组分别仅增加了0±3°、1°±5°和1°±5°(所有组间比较P<0.001)(Table 2)。
----未翻译完成 在12个月随访时,手术组18例患者中有16例能够使用患肢完成3个或3个以上的任务:如穿衣服、系鞋带、拧毛巾和使用手机。
对照组的18例患者中仅有7例能够完成2个任务、3例能够完成1个任务,剩余的8例仍然无法完成任何任务(Table S3 in the Supplementary Appendix)。
所有36例患者基线和12个月时的功能可见An interactive graphic。
(四)神经生理学评估
我们在刺激健侧C7神经的同时记录患肢桡侧伸腕肌(extensor carpi radialis)运动神经动作电位,手术组术后6个月时,有8例患者能够记录到电位;术后8个月时有14例;术后10个月和12个月时所有手术组患者都能记录到。
两组患者在基线做经颅磁刺激检测时,均在刺激损伤大脑半球(ipsilesional hemisphere)时才能引出患肢桡侧伸腕肌的运动诱发电位(motor evoked potentials)(Table 2 and Figure 2)。
手术组在术后10个月和12个月时,经颅磁刺激健侧大脑半球(contralesional hemisphere)能够诱发出患肢桡侧伸腕肌反应,其中12个月时运动响应潜伏期平均为19.2毫秒±0.7毫秒、波幅平均为1.28 mV±0.23 mV(Table 2 and Figure 2)。
术后12个月经颅磁刺激损伤大脑半球仍能在患肢桡侧伸腕肌记录到运动诱发电位,但是与基线相比波幅(amplitudes)下降、潜伏期(latencies)延长(Table 2 and Figure 2)。
对照组在12个月及更早时间点,患肢对经颅磁刺激健侧大脑半球(contralesional hemisphere)没有反应(Table 2)。患肢对刺激健侧颈神经或健侧半球均无反应。