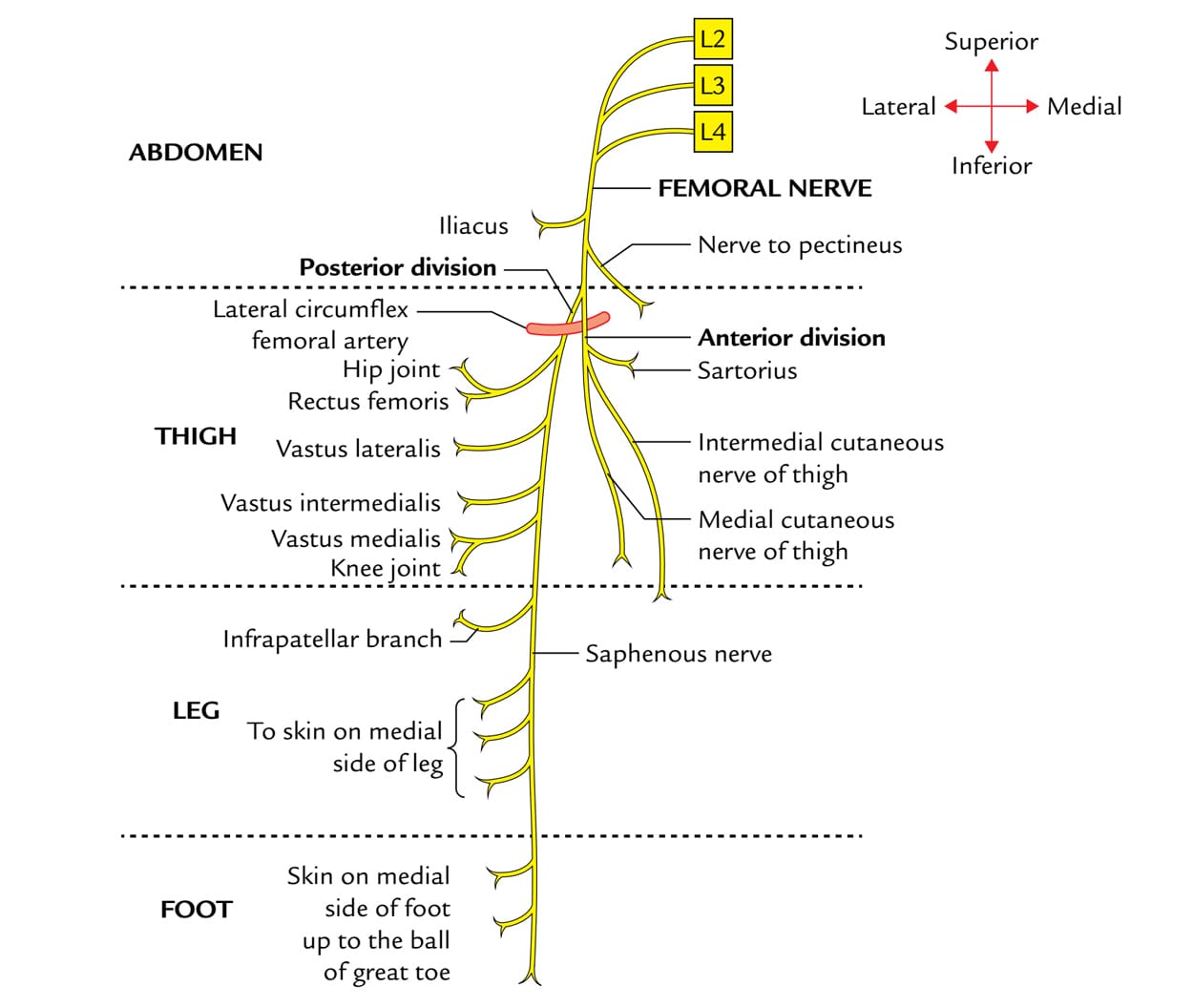
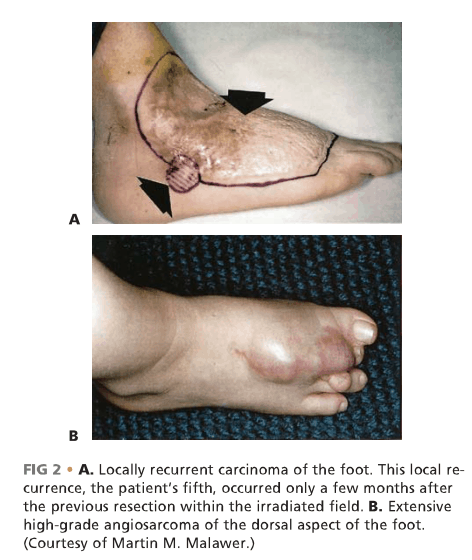
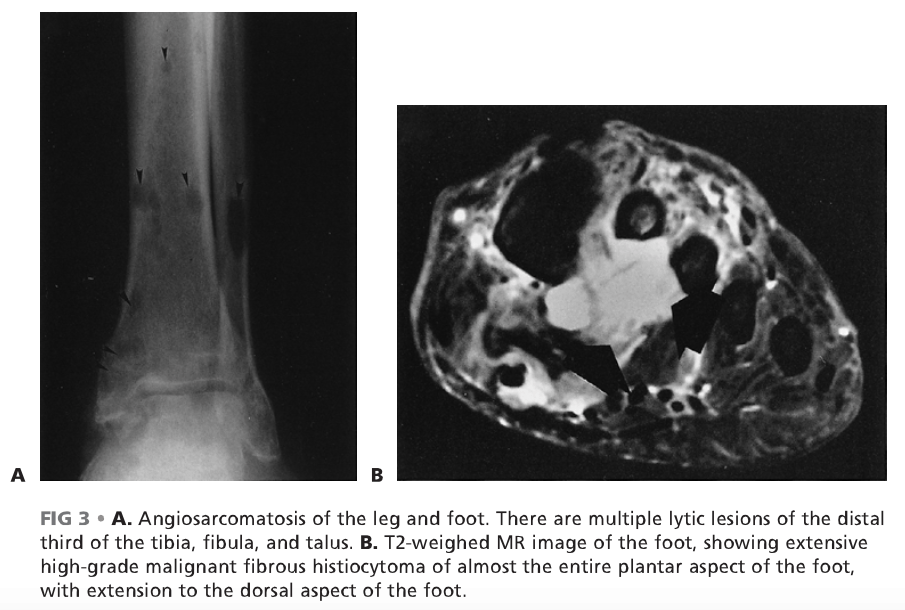
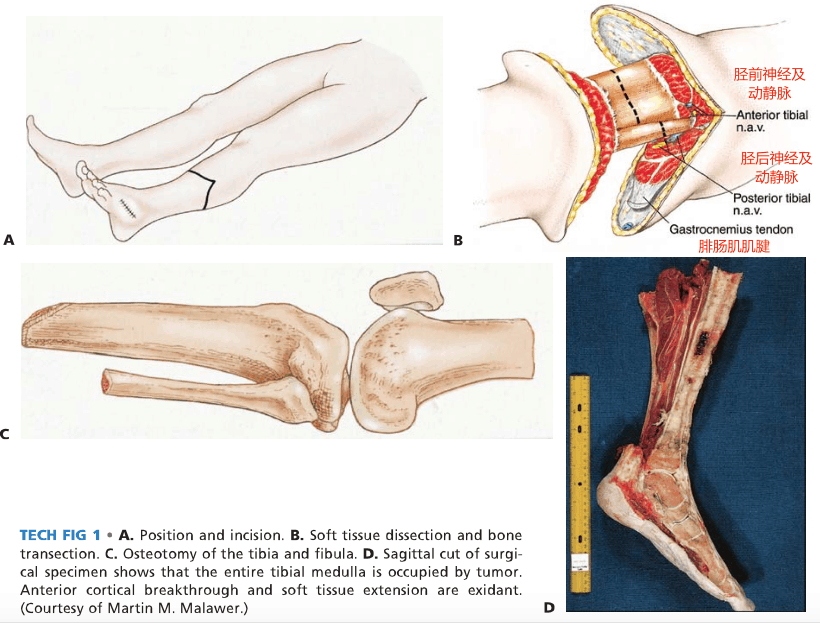
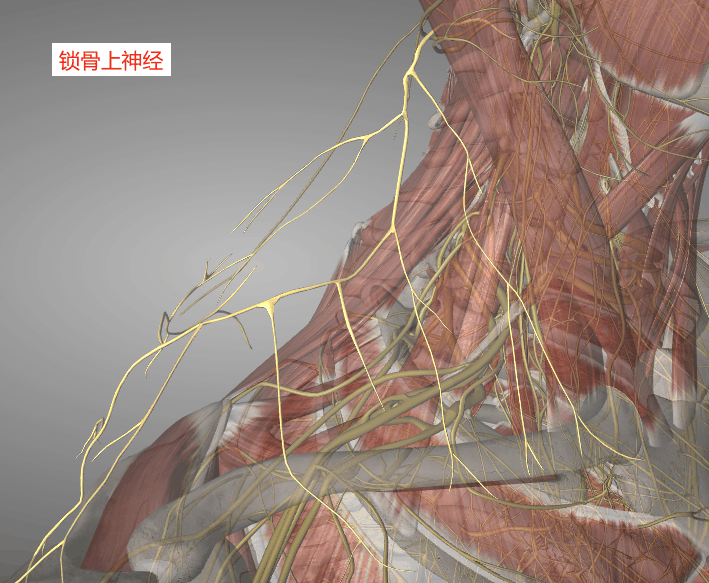
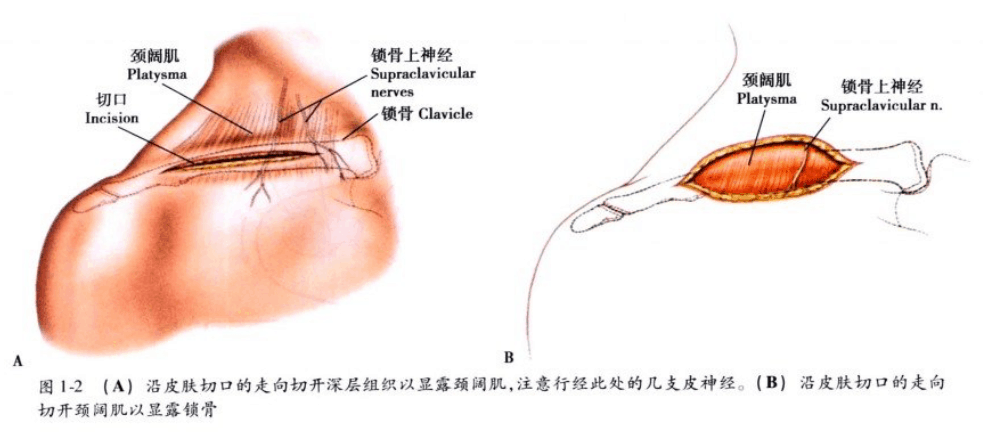
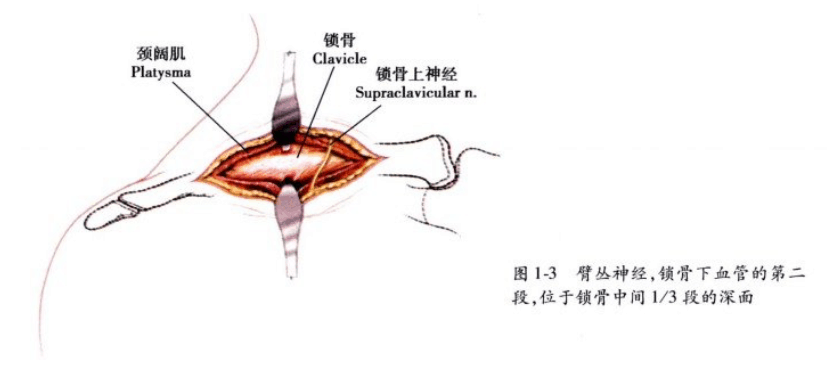
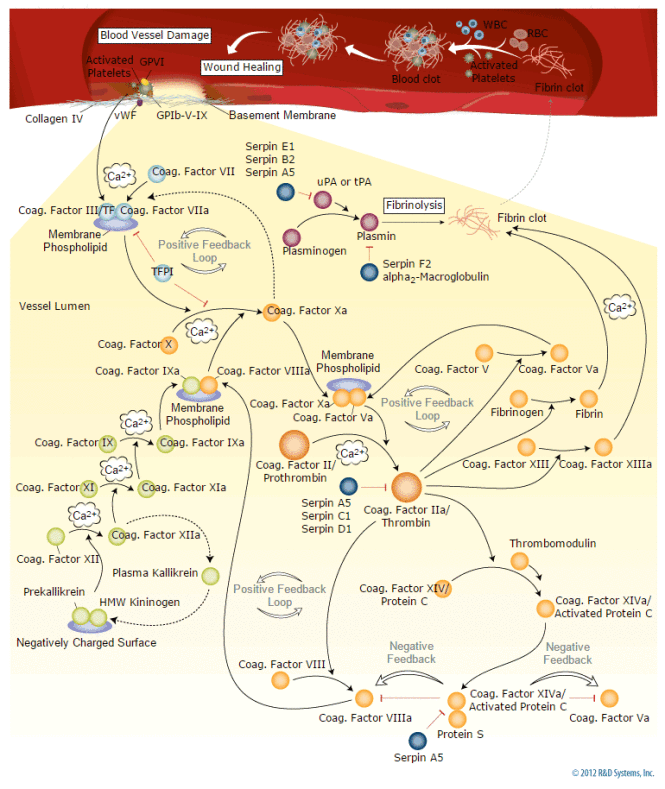
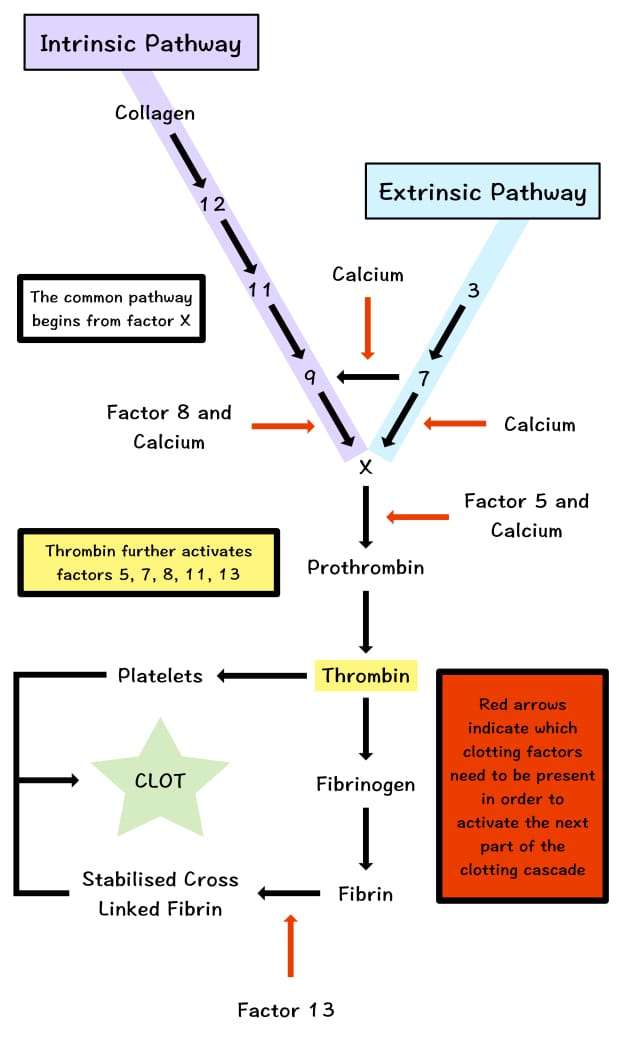
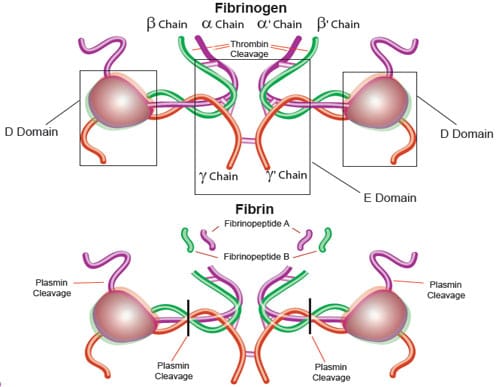
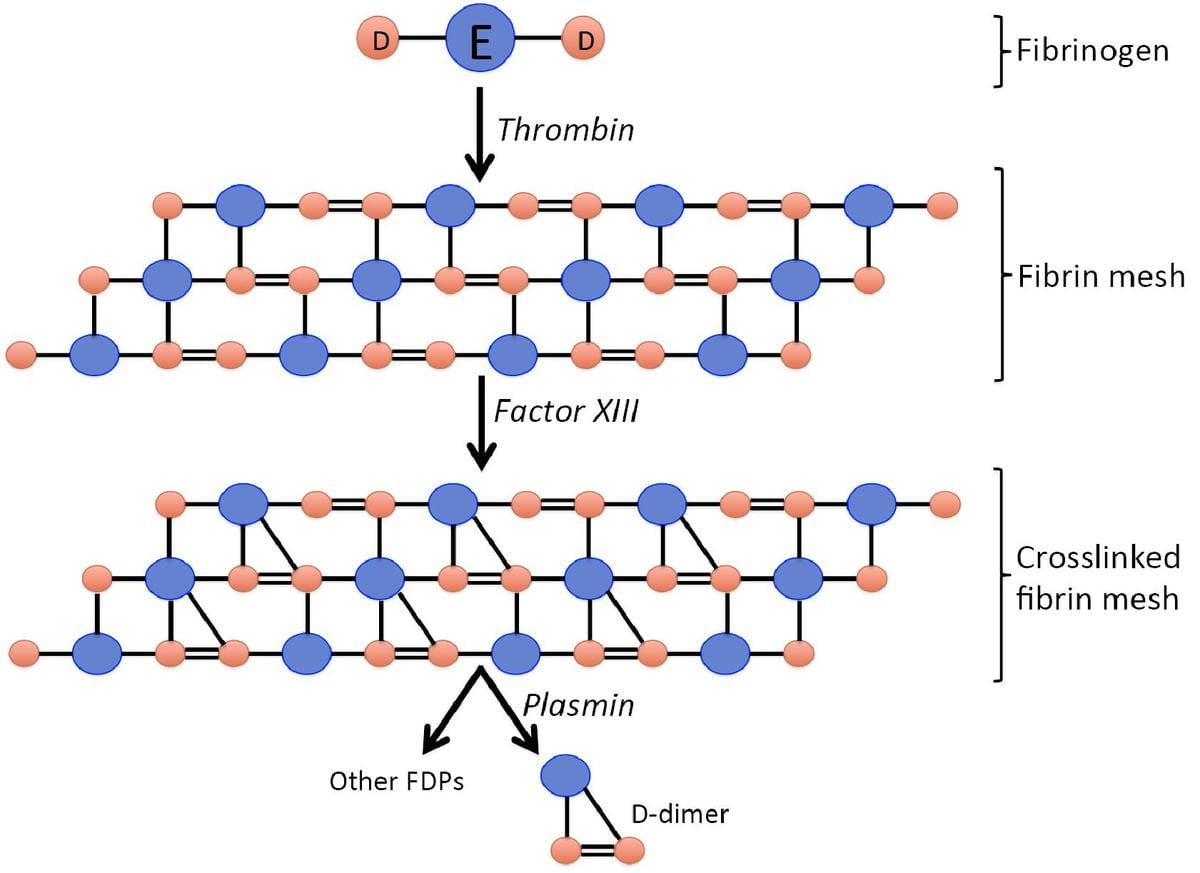
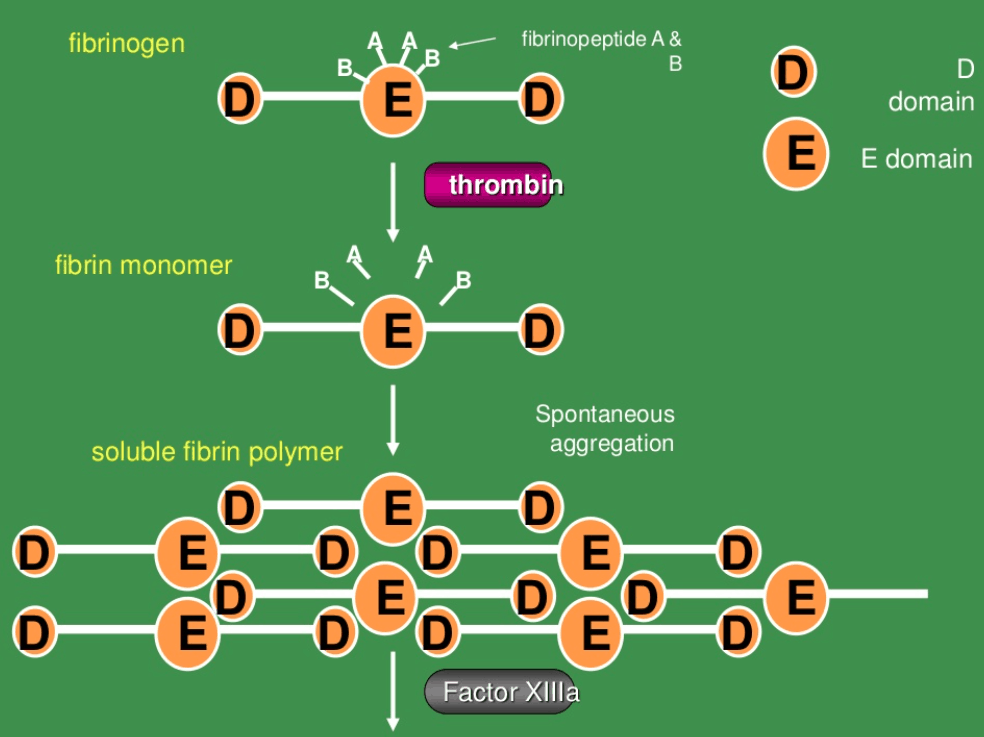
说明:
1. 翻译自Gregory B. Lim(Chief Editor, Nature Reviews Cardiology).Warfarin: from rat poison to clinical use,nature reviews cardiology,14 December 2017.
抗凝药物华法林广泛运用于预防和治疗深静脉血栓形成和肺栓塞,并且能够预防房颤患者,心脏瓣膜病患者或心脏瓣膜置换患者的中风。
华法林的发现溯源于20世纪20年代加拿大和美国北部的草原。当时人们发现,很多以前健康的牛开始死于不明原因的内出血。
牛和羊放牧在甜三叶草的干草上(sweet clover hay)。
Melilotus alba和Melilotus officinalis
当气候潮湿并且干草感染霉菌时,最常发生出血。变质的干草在正常情况下应该被丢弃,但20世纪20年代的经济困难意味着农民买不起替代饲料。于是,出血性疾病被称为“甜三叶草病(sweet clover disease)”。

当地兽医Frank W. Schofield和Lee M. Roderick调查后得出结论,发霉的甜三叶草是引起出血的原因,通过喂食时去除发霉的干草或输入新鲜血液可以逆转这种疾病。
Roderick将这种获得性凝血障碍命名为“血浆凝血酶原缺陷(plasma prothrombin defect)”。
尽管有建议不要将发霉的干草喂牛,但许多农民并未遵循这些建议,十年后甜苜蓿病(甜三叶草病)仍然普遍存在。无奈之下,威斯康星州的一位农民Ed Carlson驾车载着一头死牛来到200英里外的一个农业实验站,在那里他向生化学家Karl Link赠送了一罐不凝血。

Link及其同事开始着手识别和分离导致出血性疾病的活性化合物。他们采用了一种新的体外凝血试验,使用来自兔子的血浆来引导干草中发现的化合物的化学分馏。
They adopted a new in vitro clotting assay using plasma from rabbits to guide chemical fractionation of compounds found in the hay.
到了1940年,经过6年的努力,Link和同事们确定一种名为香豆素(coumarin)的天然物质在发霉的干草中被氧化生成3,3ʹ-methylene-bis(4-hydroxy-coumarin),后者就是更广为人知的双香豆素。
这项工作由威斯康星州校友研究基金会(Wisconsin Alumni Research Foundation,WARF)资助,该基金会于1941年获得了双香豆素专利。
1945年,Link考虑使用香豆素衍生物作为灭鼠药。双香豆素起效太慢,在灭鼠上并不实用。Link和同事研究了150种香豆素的变异结构,并发现其中第42号特别有效。其被资助机构命名为“华法林(warfarin)”,并于1948年作为灭鼠药成功上市。
1951年,一名美国士兵服下大剂量华法林灭鼠药试图自杀。这位老兄被送到医院,意外地经过维生素K治疗后就完全康复了。
随后,人们开始研究使用华法林作为治疗性抗凝药。那时,在临床上已经有可以使用的抗凝药,但肝素需要肠胃外给药,而双香豆素在产生治疗效果前有较长的滞后期。
华法林的主要优点是口服的生物利用度高(oral bioavailability),水溶性强,比双香豆素效果更强,但其作用仍可被维生素K逆转。因此,华法林(商品名Coumadin)开始进入临床使用,并于1954年被批准上市。
早期服用华法林的患者就包括美国总统艾森·豪威尔(Dwight D. Eisenhower),他在1955年因心肌梗死接受华法林治疗。
尽管应用广泛,华法林的作用机制直到1978年才被揭示,John W. Suttie等人证实,华法林通过抑制环氧化物还原酶(enzyme epoxide reductase)来破坏维生素K的代谢。