说明:
1. 翻译自Khurana G, Jindal P, Sharma JP, et al.Postoperative pain and long-term functional outcome after administration of gabapentin and pregabalin in patients undergoing spinal surgery.Spine,2014,39(6):E363-8.
抗凝药物发展史中的14个里程碑(十一):寻求最佳VTE抗凝疗程
说明:
1. 翻译自Gregory B. Lim(Chief Editor, Nature Reviews Cardiology).Quest to find the optimal duration,nature reviews cardiology,14 December 2017.
静脉血栓栓塞(Venous thromboembolism),表现为深静脉血栓形成(deep-vein thrombosis)或肺栓塞(pulmonary embolism),通常用抗凝治疗。
这种做法最初是在1969年由William Coon,Park Willis和Michael Symons开始的。他们报道说,通过几个月的肝素治疗,出院后最初12周内复发性血栓栓塞的频率显著减少。然而,鉴于研究的回顾性特点,无法得出关于肝素在这方面的有效性的确切结论。
十年后,Hull及其同事进行的一项随机对照试验的结果证实了抗凝治疗在预防复发性静脉血栓栓塞方面的益处,此外还证明华法林治疗在这种情况下比皮下注射肝素更有。正如所预料的那样,这种增加的有效性与出血风险升高有关。
VKA治疗的获益与风险并存,风险主要来自出血风险升高。很多试验试图比较不同疗程的VKA治疗VTE的获益和风险,期望找到将复发风险降低到低水平的最短抗凝治疗时间。
20世纪70年代和80年代发表的几项小型随机研究结果表明,将抗凝时间从3或6个月缩短到3~6周不增加VTE复发风险。
而1995年发表的DURAC多中心随机试验显示,口服抗凝治疗从6周延长至6个月,复发性血栓栓塞风险显著降低。
这项研究首次可靠地证实了几个患者亚组长期抗凝的益处,即使在6个月的治疗组中,大出血的风险仍然很低。因此问题仍然存在:维生素K拮抗剂治疗静脉血栓栓塞的最佳时间长度是多少?
众多后续研究尝试回答这个问题但均告失败的两个主要局限是它们仅比较治疗的两种持续时间以及纳入的样本量较少。
2011年发表的一项研究共纳入2,925名受试者(来自7个研究的数据汇总),该研究不仅增加了所评估的治疗持续时间的范围,还增加了研究所纳入的患者数量。
A total of 2,925 participants were included in the pooled study, corresponding to 4,023 patient-years of follow-up.
此外,可根据初始静脉血栓栓塞的位置将患者分为不同的亚组,以及血栓形成是否由临时危险因素引起,因为这些变量可能会影响复发风险。
12%的患者抗凝治疗时间为12或27个月,27%为6个月,36%为3个月,25%为1或1.5个月。
四个治疗组停用抗凝药物后24个月内复发性VTE风险各不相同,治疗1或1.5个月的患者复发静脉血栓栓塞的风险最高,其他三组相似(治疗3个月,6个月,12或27个月)。
研究者总结,VTE抗凝治疗通常应该在3个月时停止(如果静脉血栓栓塞患者没有无限期抗凝治疗适应症的话)。
重要的是,静脉血栓栓塞的初始表现似乎很重要,因为与单独的远端深静脉血栓形成患者相比,肺栓塞或近端深静脉血栓形成患者停止抗凝治疗后复发的风险增加了一倍。
尽管在这些患者中将治疗时间从3个月延长至6个月可能会降低复发的风险,但这种益处必须与较高的出血风险和长期治疗相关的成本增加相平衡。
抗凝药物发展史中的14个里程碑(十):NOAC的时代
说明:
1. 翻译自Gregory B. Lim(Chief Editor, Nature Reviews Cardiology).Era of the NOACs,nature reviews cardiology,14 December 2017.
自美国FDA首次批准华法林上市使用以来,在过去五十多年里,华法林是美国唯一可用的主流口服抗凝药。虽然维生素K拮抗剂(VKAs)已被证明对预防血栓栓塞非常有效,但它们的使用受限于需要频繁监测和调整剂量,以及潜在的食物和药物相互作用。
为了解决这些局限性,开发了一类新的抗凝物(称为非VKA口服抗凝药或NOACs),其目的是至少与传统抗凝药一样有效,但具有更实用的特性(如口服给药,无需常规监测或调整剂量)。
与VKA(抑制依赖维生素K的凝血蛋白的生成)不同,NOAC靶向凝血级联反应中的特定凝血因子(Xa因子或凝血酶)。目前,已经有4种NOAC被批准用于治疗多种血栓性疾病,即达比加群、利伐沙班、阿哌沙班和依度沙班。
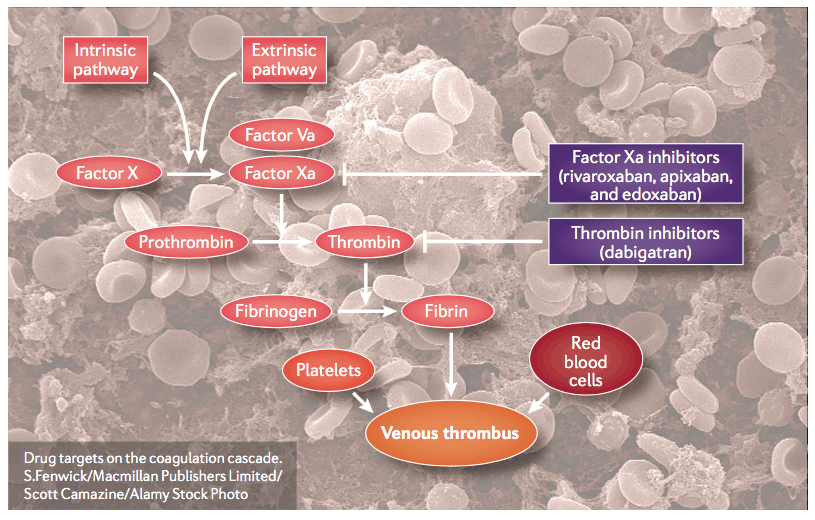
自华法林以来,达比加群酯(Dabigatran etexilate)是第一个获得长期适应症并上市的NOAC。达比加群(Dabigatran)以浓度依赖性和竞争性方式抑制血凝块的结合和游离凝血酶。
对2007年至2009年发表的RE-MODEL、RE-MOBILIZE和RE-NOVATE试验的汇总分析(pooled analysis)显示,达比加群在膝关节或髋关节置换术后血栓预防方面至少与依诺肝素(enoxaparin)等效。
RE-COVER I和II试验显示,达比加群对于治疗急性VTE的疗效不劣于华法林。
2009年的RE-LY研究纳入了18,000例房颤患者,结果表明在卒中和全身性栓塞的预防方面达比加群不劣于华法林。Dabigatran在接下来的一年中被FDA批准用于该适应症。
Rivaroxaban是第一种上市的因子Xa直接抑制剂。
2008年至2009年期间发表的RECORD I-IV试验显示,利伐沙班在预防全髋关节或膝关节置换术后VTE方面优于依诺肝素。
随后分别于2010年和2012年发表的EINSTEIN-DVT和EINSTEIN-PE试验显示,利伐沙班在VTE治疗方面不劣于依诺肝素或华法林。
2011年,ROCKET-AF试验表明,在中度至高度卒中风险的房颤患者的卒中和全身性栓塞预防中,利伐沙班不劣于华法林。利伐沙班(Rivaroxaban)于2011年获得FDA批准用于房颤和VTE预防患者的卒中预防。
Rivaroxaban was approved by the FDA in 2011 for both stroke prevention in AF and VTE prophylaxis.
阿哌沙班(Apixaban)是另一种因子Xa的直接拮抗剂。
对2009-2010年发表的三项ADVANCE试验表明,与依诺肝素相比,阿哌沙班降低了VTE发生率和全因死亡率。
2014年,Ⅲ期AMPLIFY试验发现,阿哌沙班治疗急性VTE不劣于依诺肝素或华法林。
在AF的卒中预防方面,2011年ARISTOTLE试验显示,阿哌沙班在房颤患者的卒中预防方面优于华法林,且出血事件减少。
此后,阿哌沙班(Apixaban)已被FDA批准用于所有这三种适应症。
Edoxaban是正在研究的VTE预防和治疗的最新因子Xa直接抑制剂。
2014年发表的Ⅲ期STARS-E3和STARS-J5试验显示,依度沙班(Edoxaban)预防全膝关节或髋关节置换术后血栓形成的效果不劣于依诺肝素,安全性相似。
2013年Hokusai-VTE试验是迄今为止规模最大的VTE试验,结果表明,依度沙班治疗复发性症状性VTE不劣于华法林。
ENGAGE-TIMI 48试验显示,依度沙班预防房颤患者(> 20,000例)卒中方面不劣于华法林。根据ENGAGE-TIMI 48试验的结果,Edoxaban也已经获得FDA批准用于房颤的卒中预防。
总之,这些新的凝血酶和因子Xa的直接抑制剂已经克服了传统VKA的许多实践限制,并且许多临床试验表明它们对于VTE预防和治疗以及AF的卒中预防具有至少相似的效果。此外,这些NOAC似乎与较少的大出血事件有关。
人们迫切期待在未经选择、年龄较大且患有较多合并症患者中使用这些NOAC的相关数据。
抗凝药物发展史中的14个里程碑(九):希美加群为NOAC绽放奠定基础
说明:
1. 翻译自Gregory B. Lim(Chief Editor, Nature Reviews Cardiology).Ximelagatran sets the stage for NOACs,nature reviews cardiology,14 December 2017.
在超过50年的时间里,维生素K拮抗剂华法林是口服抗凝治疗的主要支柱。
2003年,口服直接凝血酶抑制剂 (direct thrombin inhibitor, DTI)希美加群(Ximelagatran)在欧洲被批准用于骨科术后短期VTE预防。上市短短几年后,该药被制药公司在全球范围内召回,因为接受希美加群治疗的患者中观察到肝酶水平升高。鉴于上述不良反应,美国FDA拒绝该药的审批。
然而,希美加群的研发提示,凝血酶是抗凝治疗的合理候选靶点,特异性口服凝血酶抑制剂可以有效治疗血栓性疾病,而无需监测凝血。
凝血酶(Thrombin)是纤维蛋白形成的最终介质。凝血酶将纤维蛋白原裂解成纤维蛋白:纤维蛋白的交联构建了血栓网络。因此,凝血酶是抗凝治疗的合理候选靶点。
在20世纪80年代中期,阿斯利康(AstraZeneca)的一个团队发起了一个研发口服DTI的项目。基于已知的凝血酶竞争性抑制剂,从2-5个氨基酸小肽开始,他们研发了他们第一个临床候选物inogatran。
尽管通过注射的inogatran在体内具有抗凝活性和理想的药代动力学特点,但口服生物利用度<5%。
目前,计算机建模是一项新兴技术。利用核磁共振研究中的凝血酶结构,以及凝血酶与潜在抑制剂之间相互作用的能量计算,最终产生了melagatran。这种分子不仅比inogatran更有效,而且还<500 Da,该团队认为这对口服的生物利用度至关重要 (later confirmed by Lipinski's famous 'rule of five')。不幸的是,尽管melagatran的口服生物利用度在狗中>50%,但在人类中仅为3-7%。
Melagatran有三个带电荷的基团,因此这种化合物不太可能穿过肠道的粘膜屏障(mucosal barrier)。因此,研究人员试图研发一种脂溶性前体,吸收后可转化为melagatran。
为此,他们引入了一种新的胃肠道通透性模型:在具有聚碳酸酯滤膜的平板上培养单层结肠癌细胞系中通过化合物,与以前使用的大鼠肠膜(intestinal membranes)不同,它不会代谢所测试的化合物。
使用这个模型,他们发现了ximelagatran,一种melagatran的衍生物,可以有效地穿过肠黏膜屏障,并在吸收后转化为melagatran。
Ximelagatran在许多临床试验中进行了研究,包括预防骨科手术后的VTE,治疗症状性VTE,预防房颤患者卒中以及心肌梗死后主要心血管事件的二级预防。
在许多这些试验中,ximelagatran是有效的。例如,在双盲,多中心THRIVE Ⅲ试验中,ximelagatran在预防VTE延长方面优于安慰剂。在随机,双盲EXULT A试验中,在预防全膝关节置换术患者VTE上,ximelagatran的效果优于华法林。
这些研究结果促成了该药在十多个欧美国家获得审批。尽管主要终点有所改善,但大多数试验中超过6%的患者有不明原因的无症状性转氨酶水平短暂升高,这让希美加群折戟沉沙,但它为非维生素K拮抗剂类口服抗凝药(NOAC)的开发奠定了基础。
在病例对照研究中,这些肝脏事件与主要组织相容性复合物的特定等位基因(particular alleles of the major histocompatibility complex)相关,表明它们是过敏反应的一部分。
计算机建模以及肠吸收模型等工具在药物开发中大显身手。
抗凝药物发展史中的14个里程碑(八):一个良好的靶点——Xa因子
说明:
1. 翻译自Gregory B. Lim(Chief Editor, Nature Reviews Cardiology).Targeting the Xa factor,nature reviews cardiology,14 December 2017.
2002年,Turpiee及其同事发表了一项meta分析,纳入4项研究,结果显示了一种新合成的戊多糖抗凝药在抗凝方面的潜力。这就是首个选择性Xa因子间接抑制剂磺达肝癸钠。
在凝血级联反应中,凝血酶原(prothrombin)通过因子Xa转化为关键的凝血因子凝血酶(thrombin)。这种转化被抗凝血酶(antithrombin)抑制,抗凝血酶靶向作用于因子Xa和凝血酶(thrombin)。
肝素增强抗凝血酶使凝血酶和因子Xa失活的能力,而VKAs降低维生素K途径下游关键凝血因子的凝血活性。
磺达肝癸钠(Fondaparinux)属于一类新的合成戊多糖,与抗凝血酶结合,特异性抑制Xa因子而不直接作用于凝血酶(thrombin)。因子Xa的这种特异性失活抑制凝血酶的产生。
骨科手术的一个主要并发症是静脉血栓栓塞(venous thromboembolism,VTE)的形成。Turpie及其同事在2001年对接受手术的患者进行的首次剂量范围研究(first dose-ranging study)表明,每天可以给予单剂量的磺达肝癸钠(fondaparinux),无需监测剂量。
随后,在对4个随机,双盲,Ⅲ期临床试验的7,344名患者的荟萃分析中,Turpie等人研究了磺达肝癸钠在骨科大手术后预防VTE的疗效。
择期髋关节置换术,择期膝关节大手术或髋部骨折手术的患者被分为两组,一组接受每日一次剂量的磺达肝素钠,另一组接受经批准的依诺肝素(enoxaparin)(低分子量肝素)方案。
值得注意的是,与依诺肝素相比,磺达肝癸钠显著降低了VTE的发生率。而两组的不良临床相关出血事件的发生率相似。这项荟萃分析是第一次大规模的调查,结果显示戊多糖(pentasaccharides)作为人体抗凝药物的潜力。
21世纪初,普通肝素是肺栓塞的标准治疗,这是一种危及生命的疾病,导致住院患者死亡率高达10%。
2003年发表的一项开放标签试验(open-label trial)纳入2,213例急性症状性肺栓塞患者,随机分配到普通肝素组和磺达肝癸钠组(每日一次,皮下给药),结果显示二者安全性和有效性不相上下。这一发现很重要,因为与肝素不同,磺达肝癸钠可以不经监测就可以给药。
2004年,Büller等人发表了一项多中心随机双盲试验结果,在154个中心纳入2,205例深静脉血栓患者,结果表明磺达肝癸钠和依诺肝素的安全性和有效性相似。
对于急性冠脉综合征(acute coronary syndromes)患者,抗凝、抗血小板和介入治疗的联合被认为是降低缺血性冠脉事件(ischaemic coronary events)风险的标准方法,但这也增加了出血风险。
2006年发表的OASIS-5研究评估了磺达肝癸钠是否可以降低缺血事件的风险而不增加出血。
共有20,078名急性冠脉综合征患者被随机分配接受磺达肝癸钠或依诺肝素治疗。值得注意的是,磺达肝癸钠治疗大大降低了大出血风险,降低了远期致残率和死亡率,而在缺血事件保护方面效果与依诺肝素相当。
这些具有里程碑意义的研究结果提示,Xa因子是抗血栓治疗的良好靶点,并且磺达肝癸钠在靶向作用于因子Xa方面是有效的,因此临床医生现在拥有安全有效的一类不需要调整剂量的抗凝药物。
抗凝药物发展史中的14个里程碑(七):血栓形成院外治疗的突破
说明:
1. 翻译自Gregory B. Lim(Chief Editor, Nature Reviews Cardiology).A breakthrough for out-of-hospital treatment of thrombosis,nature reviews cardiology,14 December 2017.
自从1916年发现肝素和1940年发现维生素K拮抗剂华法林以来,这些药物已成为预防或治疗血栓栓塞性疾病的标准抗凝疗法。
肝素和VKA这两种抗凝药都有许多缺点,包括抗凝效果的不可预测性,这就需要频繁的实验室检测凝血功能来调整药物剂量。
20世纪70年代后期至80年代初期,低分子量肝素(low-molecular-weight heparins,LMWH)的出现开辟了VTE防治的新途径。
通过解聚(depolymerization)肝素(分子量为12,000-16,000 Da)获得了LMWH(分子量为4,000-5,000 Da)。
与普通肝素一样,LMWHs的主要抗凝作用是通过活化抗凝血酶(凝血酶的主要抑制剂)来介导的。与普通肝素的不同之处在于,LMWH的结合主要促进因子Xa的失活,而在较小的程度上促进凝血酶的失活。因为大多数LMWH太短而不足以催化抑制凝血酶,但可以诱导因子Xa的抑制。
与普通肝素相比,LMWH一样安全和有效,并且其药代动力学更优越,血浆半衰期更长(LMWH与血浆蛋白和细胞的非特异性结合水平较低),生物利用度更高,抗凝作用可预测性更好,可以皮下注射,剂量固定或根据体重调整,不需要常规实验室监测。
无需静脉注射和实验室监测意味着,LMWH可以让患者在家中接受血栓性疾病的治疗,如深静脉血栓形成或肺栓塞。在当时,这两种疾病通常需要住院接受静脉注射普通肝素治疗,然后进行口服抗凝药物治疗(最常用华法林)≥3个月。LMWH使用更方便,患者可以在家中自行注射,在降低医疗成本的同时还降低了院内感染风险。
1996~1997年,四项大型随机临床试验的发表,证实院外、不监测的皮下注射LMWH与院内静脉注射普通肝素治疗血栓性疾病的疗效和安全性相当。
1996年,Levine et al和Koopman et al的研究结果显示,深静脉血栓形成患者使用LMWH和普通肝素,两者在血栓栓塞复发率和大出血发生率上非常接近。然而,LMWH却能够允许大多数患者在家中接受治疗或早期出院。这些初步试验仅包括无症状性静脉血栓形成患者。
1997年在哥伦布(COLUMBUS)的研究中证实了无监测的皮下注射LMWH在治疗症状性血栓形成患者的有效性和安全性。该研究纳入有症状的静脉血栓形成或肺栓塞患者,还纳入了Simonneau等人的研究(纳入了有症状性肺栓塞患者)。
这些试验结果改变了血栓形成的临床管理,LMWH逐步取代普通肝素用于血栓性疾病的预防和治疗。尽管如此,LMWH仍有一些缺点,例如需要注射给药、需密切监测极端体重患者,对肾脏疾病患者有使用禁忌(因为LMWH主要通过肾脏途径清除)等,于是科学家们继续寻找更安全、更方便的抗凝药物。
抗凝药物发展史中的14个里程碑(六):INR的提出
说明:
1. 翻译自Gregory B. Lim(Chief Editor, Nature Reviews Cardiology).Birth of the INR,nature reviews cardiology,14 December 2017.
五十多年来,华法林是抗凝治疗的中流砥柱,今天仍然广泛用于临床。至今,华法林仍然是治疗静脉血栓栓塞和预防房颤患者中风最常用的口服抗凝药。
但华法林的有效性和安全性存在较大的个体差异,成为其临床应用中的困扰。因为药物的有效性和安全性很大程度上取决于将抗凝作用维持在规定的治疗范围内。
1935年,Armand Quick及其同事采用凝血酶原时间(Prothrombin time,PT)来进行口服抗凝药物监测。
该指标是加入促凝血酶原激酶试剂后血浆凝固所需时间的量度。但这一指标存在很大的缺陷。例如不同实验室的PT检测结果不一致,以及数据报告的方法不一致等(时间,比率或百分比活性/percentage activity)。此外,自身的(人脑提取物)和商业化(来自动物组织)制备的促凝血酶原激酶试剂对降低维生素K依赖性凝血因子的敏感性不同。
在20世纪60年代的北美实验室中,敏感的内部试剂被不太敏感的商业试剂取代,这无疑影响了药物剂量。
不幸的是,直到1982年Leonboro和David Taberna发表了一项关于华法林剂量的国际调查,才发现了这些差异。
据报道,北美的实验室仍在使用灵敏度较低的商用促凝血酶原激酶,故此华法林的给药剂量较高。而英国治疗中心规定的华法林剂量较低,因其使用的促凝血酶原激酶是使用人体大脑提取物内部制备的。
同年,Russell Hull及其同事发表了一项随机研究,比较了调整剂量后的华法林治疗近端静脉血栓形成患者的疗效。一组患者使用根据动物组织制造的PT试剂(北美常用)来调整华法林的剂量,另一组患者则使用根据人脑促凝血酶原激酶制备的PT试剂(英国常用)来调整华法林的剂量。该研究的结果显示,尽管目标PT比率较低,但在北美使用了明显更大剂量的华法林。重要的是,两组患者均没有受到当前静脉血栓形成的影响,但接受英国治疗方案治疗的患者,其出血并发症明显较少。
直到1977年,WHO生物标准化专家委员会(Expert Committee on Biological Standardization of the WHO)认识到需要对PT检测进行标准化,提出了校准凝血活酶的方案。
1983年,英国国家生物标准和控制研究所(UK National Institute for Biological Standards and Control)的Tom Kirkwood等人进一步完善了这一模型,以提高其校准不同类型和物种的促凝血酶原激酶的适用性。
同年,WHO专家委员会批准了这一修订方案,国际标准化比率(International Normalized Ratio,INR)由此诞生,这一检测目前仍用于监测接受VKA治疗的患者。
尽管INR相对PT的优势非常明显,但一开始在临床上使用和推广INR是非常缓慢的。然而,到1995年,美国的大多数实验室都报告了INR值,所有凝血活酶试剂(thromboplastin reagents)的制造商都需要提供其试剂的国际敏感指数,这是计算INR所必需的。VKA治疗的潜在益处与危害依赖于在较窄的INR范围内较好地控制抗凝强度。
目前,对于有复发性VTE风险者或卒中风险中-高危的房颤患者,口服抗凝的最佳INR范围是2.0-3.0,机械心脏瓣膜患者INR应保持在2.5-3.5。
Go及其同事在2003年的一项研究中证实了VKA对血栓栓塞风险(thromboembolic risk)的有益作用,他们报告说VKB可以降低大量门诊房颤患者的缺血性卒中和外周血栓栓塞风险,这与随机试验报告的结果一致。
虽然VKAs正逐渐被新的非维生素K拮抗剂类口服抗凝药所取代,但VKAs仍然是房颤和风湿性心脏瓣膜病患者以及机械心脏瓣膜患者的首选抗凝药。
抗凝药物发展史中的14个里程碑(五):大剂量肝素用于二级预防
说明:
1. 翻译自Gregory B. Lim(Chief Editor, Nature Reviews Cardiology).High-dose heparin for secondary prevention,nature reviews cardiology,14 December 2017.
到20世纪70年代末,有两种抗凝药物可用于血栓性疾病,即口服的VKA(vitamin K antagonists)和静脉注射的肝素。
静脉血栓栓塞患者,在最初时,静脉注射普通肝素≥5天。随后的标准治疗是长期口服抗凝药(最常用的是华法林)来预防静脉血栓栓塞复发。
然而使用口服抗凝药物进行二级预防的策略是基于回顾性研究而没有随机化。而且,VKA与出血并发症高风险相关。
这些问题促使Russell Hull及其同事采用随机方法评估口服抗凝药用于复发性VTE的二级预防,并将这种治疗与小剂量皮下注射肝素(已被证明出血风险较低)进行了比较。
1979年发表的一项研究中,Hull等纳入68名深静脉血栓患者,首先静脉注射肝素,然后随机分为两组进行二级预防,一组给予小剂量肝素皮下注射(每12小时5000单位),另一组给予华法林并根据凝血酶原时间(prothrombin time,PT)调整剂量(每周监测,使PT保持正常值的1.5-2.0倍)。
研究结果显示,调整剂量的华法林对预防复发性VTE更有效:华法林组33例患者中无新发VTE,而小剂量肝素组35例患者中有9例复发性VTE(P=0.001)。
然而,华法林与小剂量肝素相比出血风险更高,华法林组有7名患者出现出血性并发症,而低剂量肝素组则没有(P <0.005)。
值得注意的是,新发VTE只出现在基线时有近端静脉血栓形成的患者。
Of note, a new episode of venous thromboembolism occurred only in those patients who had proximal-vein thrombosis at baseline.(Proximal DVT is one that is located in the popliteal, femoral, or iliac veins.)
鉴于低剂量皮下注射肝素虽然比华法林更安全,但对预防静脉血栓形成无效的结果,Hull及其同事启动了一项新的随机临床试验,来评估大剂量肝素皮下注射的有效性和安全性。
106例急性近端静脉血栓形成(acute proximal-vein thrombosis)患者先静脉注射肝素治疗,然后随机分配到调整剂量的皮下注射肝素或华法林治疗组(每周监测,使PT保持正常值的1.5-2.0倍)进行二级预防。
研究开始时调整皮下注射肝素的剂量,然后固定,每12小时平均剂量为10,000单位。其目的是评估不需要连续监测的治疗,这对于需要长期治疗的二级预防而言非常方便。
数据显示,调整剂量的皮下注射肝素和华法林的有效性相当(复发性VTE发生率3.8% vs. 1.9%),而前者更安全(出血并发症1.8% vs. 17.0%)。
该试验表明,对于VTE患者的二级预防,大剂量皮下注射肝素是华法林的有效替代方法。
抗凝药物发展史中的14个里程碑(四):小剂量肝素对VTE的预防效果胜过对VTE的疗效
说明:
1. 翻译自Gregory B. Lim(Chief Editor, Nature Reviews Cardiology).Low-dose heparin for VTE — prevention is better than cure,nature reviews cardiology,14 December 2017.
肝素在20世纪30年代进入临床试验,与维生素K拮抗剂联合使用,在20世纪50年代被证明能够有效治疗急性肺栓塞。
肺栓塞是接受胸腹腔或泌尿系统等外科手术的常见并发症,可在栓塞事件发生后30分钟内导致患者死亡,留给医生的诊断和治疗窗口非常有限,因此预防很重要。
因此,20世纪70年代,临床医生进行了一系列试验来评估小剂量肝素预防术后静脉血栓形成(venous thromboembolism,VTE)的效果。
70年代中期,共有27个临床试验发表,其中最大的一项是1975年发表在《柳叶刀》的国际多中心随机试验。
4,121名接受各种择期大手术的患者随机分为两组,治疗组(n=2076)给予小剂量肝素,对照组(n=2045)不使用肝素。
治疗组中80例患者死亡,对照组中100例患者死亡,两组分别对66%和72%的病例进行了尸体解剖,发现死于急性大面积肺栓塞者分别有2例(肝素治疗组)和16例(对照组)(P<0.005)。
部分患者(治疗组625例,对照组667例)进行了125I-纤维蛋白原检测,以检测深静脉血栓形成(deep-vein thrombosis,DVT)。
肝素治疗组DVT发生率明显低于对照组(7.7% vs 24.6%; P < 0.005)。30例在尸检时发现DVT,肝素治疗组6例,对照组24例(P<0.005)。两组之间因手术或术后出血而需要输血的要求无显著的差异。
1978年,Vijay V. Kakkar发表了对不同临床试验的总结,支持上述试验结果。这些试验共纳入4000例患者,
小剂量肝素治疗组患者的静脉血栓形成的平均发生率为7%,而对照组为25%。
尽管预防静脉血栓形成具有根本重要性,但大多数肺栓塞的主要来源是下肢近端静脉中延长的血栓。因此还评估了低剂量肝素预防这种现象的效果。
在1,479名接受肝素治疗的患者中,6%的患者检测到血栓,其中仅0.6%发生了血栓的延长(thrombus extension)。
相比之下,在对照组的1,631名患者中,23%的患者检测到血栓,其中6%发生了血栓的延长。
Kakkar总结道,小剂量肝素预防术后致命性肺栓塞非常有效,并且不会发生严重的出血。
标准给药方案是术前2小时给予肝素5,000单位,然后每8–12 h给药一次,持续用药7天或直到患者可以完全自行活动(以较长的时间为准)。
现在,这种预防措施被大规模推荐用于接受腹部,胸部和泌尿系统大手术的高风险患者,以及处于发生血栓栓塞并发症中度风险的患者。
这种方法的广泛采用预计每年可挽救数千人的生命。随后的研究集中在低剂量与全剂量(low-dose versus full-dose)肝素在治疗和二级预防VTE上的效果。
抗凝药物发展史中的14个里程碑(三):肝素和VKA——成功的组合
说明:
1. 翻译自Gregory B. Lim(Chief Editor, Nature Reviews Cardiology).Heparin and a VKA — a winning combination,nature reviews cardiology,14 December 2017.
在20世纪上半叶,继Jay McLean偶然发现肝素后,Karl Link分离出维生素K拮抗剂(vitamin K antagonist,VKA)双香豆素(dicoumarol)。我们做出了相当大的努力试图将这些抗凝药应用于临床。
肝素和香豆素衍生物华法林在20世纪50年代被广泛用于治疗血栓形成。20世纪50年代后期,一些临床研究表明,这些抗凝药可能对肺栓塞的治疗有效。
1947年,Allen等人报道,329名肺栓塞患者接受肝素和双香豆素治疗后只有1例死亡。
1959年,Bauer报道,627例静脉血栓患者接受肝素治疗后,仅有5例死于肺栓塞。
然而,直到1960年,Barritt和Jordan在《柳叶刀》上发表了第一个评估这些抗凝药治疗肺栓塞的随机临床试验的结果。这项开创性的研究将对该领域产生深远的影响。
Barritt和Jordan于1957年在英国布里斯托尔(Bristol)的United Bristol Hospitals的医学和心脏病科(Departments of Medicine and Cardiology),开始为该试验招募患者。
急性肺栓塞且无抗凝禁忌证的患者被随机分配到肝素+香豆素衍生物醋硝香豆素(coumarin-derivative acenocoumarol)抗凝组和不抗凝组。
by card draw no less, demonstrating how far trial randomization has come in subsequent years
主要的疗效终点是肺栓塞死亡,次要疗效终点是非致死性复发和其他原因导致的死亡。
1958年4月,研究者对参与临床试验的35例患者进行了中期分析:不抗凝组(n=19)中有5人死于肺栓塞,抗凝组(n=16)中无死亡病例(P = 0.036)。此外,抗凝组中未发生复发,不抗凝组中有5次非致命复发。
由于中期分析时复合终点改善非常显著 (P = 0.0005),研究者Barritt和Jordan决定把所有新招募的患者都分到抗凝组。
到1959年7月,共有54名患者接受了抗凝治疗。这些患者中没有1例死于肺栓塞,只有1例非致命性复发。接受抗凝治疗患者的复合结果明显优于未接受抗凝治疗的患者(P = 0.0000014)。
这项具有里程碑意义的研究首次表明,使用肝素和维生素K拮抗剂(VKA)进行抗凝治疗能够显著降低肺栓塞死亡和复发风险,为随后的随机临床研究评估这些抗凝药治疗和预防静脉血栓栓塞铺平了道路。
这种治疗策略在今天仍然是静脉血栓栓塞(VTE)治疗的金标准。Barritt和Jordan无疑对这种疾病的治疗产生了长远的影响,并在50多年间挽救了无数人的生命。